

Eine frühzeitige Diagnose ist entscheidend, um den Verlauf der Nierenerkrankung zu beeinflussen. Ein Blick auf die Nierenparameter lässt eine nachlassende Nierenfunktion frühzeitig erkennen und schützt auch andere Organe vor Folgeschäden. Bei allen Risikogruppen wird ein systematisches Screening einmal jährlich empfohlen.
Gemäß der KDIGO Leitlinie (Kidney Diseases – Improving Global Outcomes) wird das Ausmaß der chronischen Nierenerkrankung über wiederholte Messung der geschätzten glomulären Filtrationsrate (eGFR) und/oder Albuminausscheidung (UACR: Urine-Albumin-Creatinine-Ratio) ermittelt. Die Einteilung erfolgt über fünf eGFR und drei Albuminurie Stadien (4, Grafik 2).
Die Verschlechterung der Nierenleistung ist von beiden Messwerten abhängig. Während der eGFR Wert Aufschluss über die Filtrationsrate gibt, können anhand der Albuminurie strukturelle Veränderungen festgestellt werden. Bei einer anhaltenden eingeschränkten eGFR unter 60ml/min/1,73 m2 und/oder einer anhaltenden Albuminausscheidung von mehr als 30mg/g pro Tag über den Harn spricht man von einer chronischen Nierenerkrankung (12). Die eGFR wird im Serum gemessen und ist abhängig vom Serum-Kreatinin, Geschlecht, Ethnie und Alter des Patienten (13). Für die Berechnung der eGFR fließen diese Faktoren in die empfohlene Berechnungsformel, die CKD-EPI-Formel (Chronic Kidney Disease Epidemiology Collaboration), ein. Diese Berechnungsmethode ermöglicht eine präzise Einstufung der Nierenleistung bei eGFR Werten <60ml/min/1,73m2 (14).
Eine renale Schädigung kann allerdings schon bei einer mäßig eingeschränkten eGFR von über 60ml/min/1,73m2 vorliegen (15). Um diese zu erkennen, bedarf es der zusätzlichen Messung von Harnparametern wie der UACR. Für diesen sensitiven Verlaufsparameter wird in einer Spontanurinprobe Kreatinin und Albumin bestimmt. Die Messung des UACR-Wertes liefert einen zuverlässigen Hinweis auf eine Nierenschädigung und ermöglicht eine frühzeitige Diagnose, um die Krankheitsprogression zu verhindern. Bei Vorliegen von Risikofaktoren empfiehlt es sich daher, einmal jährlich neben eGFR auch die UACR zu beobachten.
PatientInnen mit chronischer Nierenerkrankung haben ein hohes Risiko für Herzinsuffizienz und kardiovaskulären Tod (16). Für beide Krankheiten ist eine frühe Diagnose von großer Wichtigkeit. Die Bedeutung renaler Parameter für die Abschätzung des kardiovaskulären Risikos wurde in einer großen Metaanalyse aufgezeigt (17, Grafik 3). Dabei korrelierten sowohl eGFR als auch UACR mit kardiovaskulärer Mortalität, wobei die Albuminurie der frühere Prädiktor ist. Insbesondere PatientInnen mit Diabetes und Bluthochdruck und normaler eGFR profitieren von der sensitiveren Risikoprognose des UACR-Wertes.
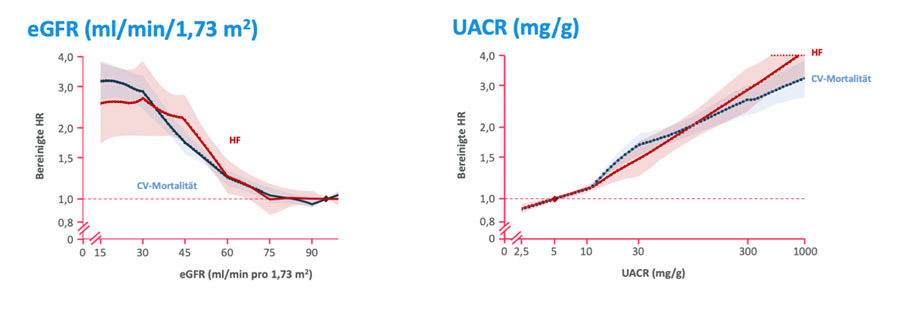
Legende: CV-Mortalität (kardiovaskuläre Sterblichkeit), HF (Heart Failure), HR (Hazard Ratio); Grafik 3: Korrelation von eGFR und UACR mit kardiovaskulärem Tod (17). Adaptiert nach Matsushita K et al. Lancet Diabetes Endocrinol 2015;3:514-525; Fox CS et al. Lancet 2012;380:1662-1673 (18);
Bei PatientInnen mit einem oder mehreren Risikofaktoren wie Bluthochdruck, Typ-2- Diabetes, Übergewicht, oder Herzerkrankungen wird neben der eGFR die jährliche Bestimmung der Albuminurie als Screeningmethode empfohlen. Sowohl eGFR als auch UACR sind unabhängig voneinander wichtig in Hinblick auf ihre Vorhersagekraft für Nierenschäden, kardiovaskuläre Ereignisse und Mortalität. Durch die frühzeitige Diagnose können Erkrankungs- und in weiterer Folge Sterbefälle verhindert werden. (1, 17, 19)
Die österreichische Diabetesgesellschaft (ÖDG) empfiehlt in ihren Leitlinien bei Diabetes folgendes Screening:
Bei zwei positiven Testresultaten bzw. bei bereits vorhandener diabetischer Nierenerkrankung werden engmaschigere Kontrollen zwei bis vier Mal jährlich empfohlen (20).
Literatur:
PP-KER-AT-0119-1-2023-03
AT-8666 03/2023